A reveladora relação entre doenças “autoimunes” e detritos mitocondriais: quem nasceu primeiroɁ
Ou: problemas mitocondriais estarão por trás das doenças autoimunesɁ Uma experiência aponta nessa direção
[Imagem: pikabu.ru]
[Este artigo já foi publicado no nosso antigo blog do substack ao qual, recentemente,me foi vetado o acesso para postar novas publicações. Dessa forma e para que possa ser conhecido pelos leitores deste novo blog -intitulado outramedicina2024.substack.com - , faço aqui a republicação do artigo]
Esta nota poderia começar assim: você continua achando que a doença autoimune é uma reação do corpo contra o próprio corpo, se autodestruindoɁ Então se prepare para entender as coisas de outra forma, ao menos se você focar atentamente em uma experiência feita há pouco tempo, na Universidade da Califórnia, com mitocôndrias. [Embora, há décadas, R. Peat vem argumentando na mesma direção, sobre a natureza da doença chamada autoimune].
A história é mais ou menos a seguinte.
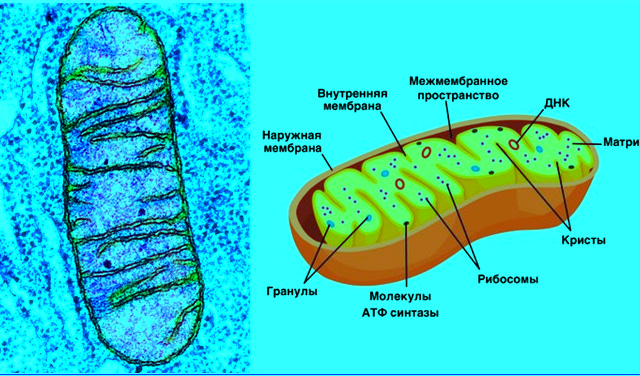
Estresse promove lesões, disfunção e destruição mitocondrial. Este processo cria detritos, no caso resíduos ou restos mitocondriais, que são lançados no citoplasma e, ato contínuo, no plasma. Sua circulação cria problemas.
Operam, quando circulantes, como sinalizadores que acionam respostas e moléculas inflamatórias. Respostas do tipo das que costumam definir praticamente toda doença chamada autoimune. No momento em que esta doença é exacerbada, aqueles detritos aparecem, como elemento característico. Só que, a partir dessa experiência [A] abaixo citada, aqueles detritos aparecem claramente como causa.
Já se tinha observado, sem dúvida, que pacientes com tais doenças apresentam elevados níveis de detritos mitocondriais no plasma. Mas, como argumenta G Dinkov, que deu destaque ao tema, “a medicina e seus cúmplices da Big Pharma foram rápidos em anunciar que aquele vínculo não era causal e sim que os detritos são resultado do ataque do sistema imune ao tecido ou órgão”[C].
Não é bem assim. E a importância do estudo abaixo [A] é de mostrar que aquele vínculo é causal.
Isto é, como resume Dinkov, “é a presença de fragmentos celulares/mitocondriais no citoplasma e na corrente sanguínea que dispara a cascata /resposta inflamatória sistêmica” [A].
O estudo também mostrou que um estresse agudo ou crônico leva à liberação de tais detritos celulares/mitocondriais, os quais diretamente disparam os sinais para a doença. O estresse impacta e desestrutura parcialmente a mitocôndria.
Isso cria um problema extra para a versão oficial.
Se se trata, primariamente de um problema mitocondrial, de estresse mitocondrial e não da imunidade atacando tecidos, e nem é inflamatório de origem, o protocolo usual para tais doenças – que vem a ser o uso de cortisol/glicocorticoide – não se dirige à raiz do problema. Está longe de contribuir para a cura do problema que se encontra lá no estresse mitocondrial.
Os glicocorticoides tipo cortisol são, por outro lado, catabólicos por sua natureza e, como explica Dinkov, eles mesmos podem aumentar o nível de detritos celulares, e exacerbam enzimas inflamatórias [COX, LOX e outras] e o processo inflamatório termina pior que antes. E se o paciente seguir com o corticoide ao longo do tempo, a consequente supressão da imunidade pode levar a câncer.
Não é uma opção “terapêutica” tranquila, para dizer o mínimo.
A abordagem terapêutica correta seria outra, não catabólica como a abordagem padrão, mas sim anabólica. Não agregar mais destruição e sim entrar com processos de construção, regeneração.
Já se sabe que esteroidais como a testosterona fazem isso. Também pregnelolona, progesterona.
Mas, de saída, seria um problema para a narrativa oficial: testosterona é anti-cortisol. Por isso é anabólica. Em vez da testosterona, mais eficiente ainda seria, provavelmente o DHT [que não tem como ser aromatizado a estrogênio; aromatização é provável com a testosterona em um organismo inflamado]. Ou também pregnelolona, progesterona.
Outras substâncias antiinflamatórias como AAS, niacinamida [esta aumenta os níveis de NAD+, medida que demonstrou ser terapêutica em doenças chamadas autoimunes], ou então a combinação pregnelolona /AAS ou progesterona /AAS e assim por diante. Esta é a abordagem terapêutica – oposta ao approach padrão – que o estudioso G Dinkov, seguindo R. Peat, propõe para aquele problema dos detritos [debris] mitocondriais e suas consequências inflamatórias.
Em suma, ele propõe um debate terapêutico baseado em esteroidais anabólicos em oposição ao usual padrão de usar glicocorticoides.
Não temos como avaliar sua viabilidade ou eficácia.
Mas fica aberta a discussão: qual o potencial estratégico de um esteroidal tipo pregnelolona associado a um anti-inflamatório como o AAS na abordagem de tais doençasɁ
Ao menos a causa do problema aponta nessa direção terapêutica. Isto é, aquela instabilidade mitocondrial, geradora de resíduos que inflamam tecidos ao circularem no plasma desencadeando processos inflamatórios indica um processo de estresse em marcha; e, sendo assim, hormônios do estresse e esteroidais anti-estresse e pró-mitocôndria cumpririam um papel oposto, benéfico sistemicamente.
Afinal a explicação da doença – lúpus, artrite reumatoide, diabetes etc - sai daquela zona nebulosa e pouco explicativa da auto-agressão.
O trabalho aqui citado [A] [B] é terminante a esse respeito: não é a doença “autoimune” que promove os detritos celulares/mitocondriais, mas sim o contrário [D].
Suas conclusões: “quando mitocôndrias estressadas, danificadas ou disfuncionais expelem DNA oxidado e quebrado para o citosol – o fluido celular no qual flutuam as organelas – e para além, para dentro da corrente sanguínea, dispara inflamação. Em doenças autoimunes como lúpus e artrite reumatoide, as quantidades de DNA mitocondrial oxidado circulante se correlacionam com a severidade da doença”.
E avança mais: “além de apontar nova explicação para explicar a inflamação, por fragmentos de DNA mitocondrial oxidado, este trabalho abre a porta para o desenvolvimento de novos agentes anti-inflamatórios”. A explicação: quando há sinais de perigo, de estresse, uma resposta imediata é a captação de ions cálcio do citosol, o que resultará na geração de espécies reativas de oxigênio [ROS] que levam à formação de DNA mitocondrial oxidado e a abertura de poros na membrana mitocondrial pelos quais DNA-m oxidado escapa.
Processos de estresse ocorrem, por exemplo, por jejum prolongado, por exercício extenuante cronicamente, por deficiências nutricionais ao longo do tempo, por instabilidade glicêmica [consumo de amidos, açucarfobia], quadros de estresse emocional – todos esses desencadeantes de cortisol e adrenalina - e assim por diante.
Os autores não deixam margem a dúvidas: estresse metabólico faz mitocôndria reagir desprendendo partículas suas, pedaços de DNA, os debris, que vão alcançar a corrente sanguínea e agredir tecidos e órgãos.
É importante reiterar - mais uma vez - que se trata de uma explicação bem distinta da usual [“autoagressão”] para a gênese da doença autoimune. Os autores vão além e explicam que o DNA mitocondrial oxidado que cai no citoplasma é grudado a sensores, complexos sensores proteicos chamados de inflamassomas, os quais acionam a produção de citocinas, moléculas que recrutam e fazem proliferar as células imunes. O resultado é uma inflamação enlouquecida característica de muitas doenças autoimunes.
É importante observar que esse trabalho [A] [B] elaborado há poucos anos atrás, revisita e revisa um tema que, da forma como é narrado pela medicina oficial, leva a um protocolo de tratamento, o atual, que tudo indica estar fazendo mais mal do que bem [por sua natureza catabólica, como foi explicado no início] e que é fruto do não entendimento da natureza mitocondrial, de estresse mitocondrial, dessas doenças.
G Dantas [Publicado originalmente em Brasília 23-10-23]
As informações aqui presentes não pretendem servir para uso diagnóstico, prescrição médica, tratamento, prevenção ou mitigação de qualquer doença humana. Não pretendem substituir a consulta ao profissional médico ou servir como recomendação para qualquer plano de tratamento. Trata-se de informações com fins estritamente educativos. Nenhuma das notas aqui presentes, neste blog, conseguirá atingir o contexto específico do paciente singular, nem doses, modo de usar etc. Este trabalho compete ao paciente com seu médico. Isso significa que nenhuma dessas notas - necessariamente parciais - substitui essa relação.
Referências ____________________
[A] XIAN H, WATARI K, 2022. Oxidized DNA fragments exit mitochondria via mPTP- and VDAC-dependent channels to activate NLRP3 inflammasome and interferon signaling. ARTICLE| VOLUME 55, ISSUE 8, P1370-1385.E8, AUGUST 09, 2022 Published:July 13, 2022DOI:https://doi.org/10.1016/j.immuni.2022.06.007
Highlights -Ca2+ uptake via MCU triggers IMM mPTP opening to induce OMM VDAC oligomerization
Ox-mtDNA is repaired by OGG1 or cleaved by FEN1 to fragments that exit mitochondria
Cytosolic Ox-mtDNA activates NLRP3 inflammasome and cGAS-STING and escapes cells
mtOGG1 and FEN1 inhibitors suppress acute peritonitis and reduce circulating mtDNA
Summary - Mitochondrial DNA (mtDNA) escaping stressed mitochondria provokes inflammation via cGAS-STING pathway activation and, when oxidized (Ox-mtDNA), it binds cytosolic NLRP3, thereby triggering inflammasome activation. However, it is unknown how and in which form Ox-mtDNA exits stressed mitochondria in non-apoptotic macrophages. We found that diverse NLRP3 inflammasome activators rapidly stimulated uniporter-mediated calcium uptake to open mitochondrial permeability transition pores (mPTP) and trigger VDAC oligomerization. This occurred independently of mtDNA or reactive oxygen species, which induce Ox-mtDNA generation. Within mitochondria, Ox-mtDNA was either repaired by DNA glycosylase OGG1 or cleaved by the endonuclease FEN1 to 500–650 bp fragments that exited mitochondria via mPTP- and VDAC-dependent channels to initiate cytosolic NLRP3 inflammasome activation. Ox-mtDNA fragments also activated cGAS-STING signaling and gave rise to pro-inflammatory extracellular DNA. Understanding this process will advance the development of potential treatments for chronic inflammatory diseases, exemplified by FEN1 inhibitors that suppressed interleukin-1β (IL-1β) production and mtDNA release in mice.
Introduction - Inflammation encompasses a series of protective reactions mounted by the evolutionarily conserved innate immune system that benefit the host by eliminating pathogens and restoring cellular and organismal homeostasis (Karin, and Clevers, 2016 Kotas, and Medzhitov, 2015). But when not properly terminated, inflammation ceases to be beneficial and becomes pathogenic. In response to chemically and physically diverse triggers of cell injury, nucleotide-binding domain and leucine-rich repeat protein-3 (NLRP3) inflammasome, a key sensor and effector of tissue damage, is activated resulting in caspase-1 (Casp1)-mediated proteolytic interleukin-1β (IL-1β) and interleukin-18 (IL-18) processing and secretion (Gross et al., 2011). The NLRP3 inflammasome is a large cytosolic complex formed by the sensor NLRP3, the ASC (adaptor apoptosis-associated speck-like protein containing a caspase activation and recruitment domain [CARD]) scaffold, the protein kinase NIMA related kinase 7 (NEK7), and the effector pro-Casp1. After a sterile injury, NLRP3 exposes its pyrin domain (PYD) to bind ASC, which uses its CARD to recruit pro-Casp1, trigger its self-cleavage, and release its active p20 fragment that converts pro-IL-1β and pro-IL-18 to their mature and pro-inflammatory forms (Gross et al., 2011 Lu et al., 2014). Recent studies have shed further light on this process, revealing that inactive NLRP3 forms a double ring cage held together by leucine-rich repeat (LRR) interactions that shield the PYD and prevent premature activation (Andreeva et al., 2021). Yet, the precise pathway leading to NLRP3 inflammasome assembly and activation after cell injury remains nebulous. Importantly, persistent NLRP3 signaling underlies many chronic diseases and metabolic pathologies, including obesity, type 2 diabetes, atherosclerosis, inflammatory bowel diseases, gout, and periodic fevers, as well as neurodegenerative disorders, including Parkinson’s and Alzheimer’s diseases (AD) (Halle et al., 2008; Heneka et al., 2015; Lamkanfi, and Dixit, 2012; Mangan et al., 2018). Thus, an improved understanding of the NLRP3 inflammasome activation pathway may advance treatment development for diverse diseases.
NLRP3 inflammasome activation follows a “two-step” route: priming and activation. Priming is initiated by Toll-like receptors (TLRs), which sense pathogen- (PAMPs) or danger- (DAMPs) associated molecular patterns and trigger nuclear factor kappa-light-chain-enhancer of activated B cells (NF-κB)-induced NLRP3 and pro-IL-1β transcription. Activation entails NLRP3 inflammasome assembly, Casp1 activation, and IL-1β maturation. Heretofore, it has been unclear how diverse stimuli, referred to as NLRP3 activators, which include adenosine triphosphate (ATP), pore-forming toxins, and different microcrystals (Broz, and Dixit, 2016; Latz et al., 2013), trigger the abrupt priming-to-activation transition. Mitochondria are key coordinators of this process (Gurung et al., 2015;Nakahira et al., 2011; Shimada et al., 2012; Zhong et al., 2019; Zhong et al., 2018; Zhong et al., 2016; Zhou et al., 2011). Moreover, we previously found that in addition to NF-κB activation, TLR engagement results in the interferon regulatory factor-1 (IRF1)-dependent induction of cytidine monophosphate kinase 2 (CMPK2), a rate-limiting mitochondrial nucleotide kinase needed for initiation of mtDNA synthesis (Xian et al., 2021;Zhong et al., 2018). Before its compaction into nucleoids, newly synthesized mtDNA is exposed to reactive oxygen species (ROS), produced upon the loss of mitochondrial membrane potential triggered by along with calcium influx and potassium efflux (Gurung et al., 2015;Zhong et al., 2016). This results in the generation of Ox-mtDNA that is released to the cytosol where it binds NLRP3 to trigger NLRP3 inflammasome assembly (Shimada et al., 2012;Xian et al., 2021; Zhong et al., 2018). However, the mechanisms accounting for Ox-mtDNA processing and exit from stressed, but still intact, mitochondria remained unknown (Murphy, 2018). Another target for cytosolic mtDNA is the DNA-sensing enzyme cyclic GMP-AMP (cGAMP) synthase (cGAS), which leads to the activation of stimulator of interferon genes (STING) and production of type I interferons (IFN), which further amplify the inflammatory response (Ablasser, and Chen, 2019;Barber, 2015; Chen et al., 2016). Although NLRP3 shows a clear preference for 8-oxoguanine (8-oxoG) -containing DNA (Zhong et al., 2018), cGAS senses any kind of dsDNA. Although extramitochondrial mtDNA has been shown to activate cGAS-STING Riley, and Tait, 2020;Wu et al., 2021), this response has not been shown to be triggered by external stimuli, especially not NLRP3 inflammasome activators or “agonists.” We now reveal how Ox-mtDNA is processed to smaller fragments that enter the cytosol to trigger NLRP3 inflammasome assembly and activation, as well as STING phosphorylation, which mediates subsequent IFN production by non-apoptotic macrophages (Chen et al., 2016; Liu et al., 2015). The same pathway also accounts for the release of circulating cell-free (ccf) mtDNA, a systemic inflammatory mediator (Oka et al., 2012; Zhong et al., 2019).
Declaration of interests - M.K. is a founder of Elgia Pharmaceuticals, a member of its scientific advisory board, and received research support from Gossamer Bio, Jansen Pharmaceuticals, and Merck. UCSD is in the process of applying for a patent covering the generation and use of novel anti-inflammatory therapy for ARDS listing H.X., E.S.-L., and M.K. as inventors.
References
BROZ P DIXIT VM 2016. Inflammasomes: mechanism of assembly, regulation and signalling. Nat. Rev. Immunol. 2016; 16: 407-420 View in Article Scopus (1943) PubMed
CROTEAU D L 1997. Repair of oxidative damage to nuclear and mitochondrial DNA in mammalian cells. J. Biol. Chem. 1997; 272: 25409-25412 View in Article Scopus (419) PubMed
DESLER C LILENES M S 2018. The role of mitochondrial dysfunction in the progression of Alzheimer’s disease. Curr. Med. Chem. 2018; 25: 5578-5587 View in Article Scopus (34) PubMed
DUVVURI B LOOD C 2019. Cell-free DNA as a biomarker in autoimmune rheumatic diseases. Front. Immunol. 2019; 10: 502 View in Article Scopus (144) PubMed
ELLIOTT E I SUTTERWALA F S, 2015. Initiation and perpetuation of NLRP3 inflammasome activation and assembly. Immunol. Rev. 2015; 265: 35-52 View in Article Scopus (595) PubMed.
GRAILER J J CANNING B A, 2014. Critical role for the NLRP3 inflammasome during acute lung injury. J. Immunol. 2014; 192: 5974-5983 View in Article Scopus (247) PubMed.
GROSS O THOMAS C J 2011. The inflammasome: an integrated view. Immunol. Rev. 2011; 243: 136-151 View in Article Scopus (612) PubMed
GURUNG P LUKENS J R, 2015. Mitochondria: diversity in the regulation of the NLRP3 inflammasome. Trends Mol. Med. 2015; 21: 193-201 View in Article Scopus (265) PubMed
HALLE A HORNUNG V, 2015. Innate immunity in Alzheimer’s disease. Nat. Immunol. 2015; 16: 229-236 View in Article Scopus (534) PubMed Nature. 2013; 493: 674-678
HORNUNG V LAMKANFI M, 2012. Inflammasomes and their roles in health and disease.Annu. Rev. Cell Dev. Biol. 2012; 28: 137-161 View in Article Scopus (746) PubMed.
LATZ E XIAO, T S 2013. Activation and regulation of the inflammasomes. Nat. Rev. Immunol. 2013; 13: 397-411 View in Article Scopus (2156) PubMed Crossref Google Scholar
NAKAHIRA K HASPEL J A 2011. Autophagy proteins regulate innate immune responses by inhibiting the release of mitochondrial DNA mediated by the NALP3 inflammasome. Nat. Immunol. 2011; 12: 222-230 View in Article Scopus (2209) PubMed
OKA T HIKOSO S, 2012. Mitochondrial DNA that escapes from autophagy causes inflammation and heart failure. Nature. 2012; 485: 251-255 View in Article Scopus (867) PubMed
PASTUKH V M, GORODNYA O M, 2016. Regulation of mitochondrial genome replication by hypoxia: the role of DNA oxidation in D-loop region. Free Radic. Biol. Med. 2016; 96: 78-88 View in Article Scopus (37) PubMed
PÉREZ-TREVIÑO P, VELÁSQUEZ M, 2020. Mechanisms of mitochondrial DNA escape and its relationship with different metabolic diseases. Biochim. Biophys. Acta Mol. Basis Dis. 2020; 1866: 165761 View in Article Scopus (50) PubMed.
RICCI C PASTUKH V, 2008. Mitochondrial DNA damage triggers mitochondrial-superoxide generation and apoptosis. Am. J. Physiol. Cell Physiol. 2008; 294: C413-C422 View in Article Scopus (120) PubMed https://www.cell.com/immunity/fulltext/S1074-7613(22)00280-1?_returnURL=https%3A%2F%2Flinkinghub.elsevier.com%2Fretrieve%2Fpii%2FS1074761322002801%3Fshowall%3Dtrue
[B] University of California, 2011. How mitochondrial damage ignites the 'auto-inflammatory fire'. Date:July 13, 2022 Source: University of California - San Diego
Summary: Researchers describe the biochemical pathway that results in the generation of oxidized mitochondrial DNA, how it is expelled by mitochondria and how it triggers the complex and destructive inflammatory response that follows.
Mitochondria are self-contained organelles (they possess their own mini-chromosome and DNA) residing within cells and are charged with the job of generating the chemical energy needed to fuel functions essential to life and well-being.
When stressed, damaged or dysfunctional, mitochondria expel their DNA (mtDNA), oxidized and cleaved, into the cytosol -- the fluid within a cell in which organelles float -- and beyond into the bloodstream, triggering inflammation. In autoimmune conditions like lupus and rheumatoid arthritis, the amounts of circulating oxidized mtDNA correlate with disease severity, flare-ups and how well patients respond to therapies.
An unanswered question that has plagued the field is whether oxidized mtDNA is simply a biomarker or indicator of disease or something more: a critical player in disease pathology.
In a new study, published the July 13, 2022 issue of the journal Immunity, researchers at University of California San Diego School of Medicine, with colleagues elsewhere, describe the biochemical pathway that results in the generation of oxidized mtDNA, how it is expelled by mitochondria and how it triggers the complex and destructive inflammatory response that follows.
"In addition to charting a new pathway responsible for the generation of inflammation-provoking fragments of oxidized mtDNA, this work opens the door to the development of new anti-inflammatory agents," said senior study author Michael Karin, PhD, Distinguished Professor of Pharmacology and Pathology at UC San Diego School of Medicine.
When macrophages -- a type of white blood cell that detects infections and tissue damage and marshals other immune system cells to respond -- are exposed to metabolic danger signals, one of the immediate responses is for mitochondria to rapidly take up calcium ions from the cytosol, which results in the generation of reactive oxygen species that lead to formation of oxidized mtDNA and the opening of pores in the mitochondrial membranes through which oxidized mtDNA escapes.
"However this oxidized mtDNA is large and before it can sneak through the mitochondrial pores, it needs to be chopped into smaller fragments," said Hongxu Xian, PhD, the study's first author and a postdoctoral scholar in Karin's lab. "That job is carried out by an enzyme called FEN1."
Once chopped by FEN1, oxidized mtDNA fragments enter the cytosol where they can bind with two different sensors: NLRP3 and cGAS. NLRP3 is part of a multi-protein complex called the inflammasome that activates inflammatory responses. cGAS is an enzyme that generates a small molecule that acts as a chemical messenger to encourage production of other cytokines -- proteins that stimulate, recruit and proliferate immune cells.
Together, NLRP3 and cGAS spur inflammation, which in autoimmune diseases has characteristically run amok, prompting the immune system to attack and destroy healthy cells and tissues.
The new findings, said Xian, highlight the critical role of FEN1 in fueling the "auto-inflammatory fire." Importantly, Xian and colleagues have demonstrated that FEN1 inhibitors block NLRP3 and cGAS signaling and thereby prevent the onset of the inflammatory process.
"This work is important not only because it can explain the origin and pathogenesis of common rheumatic diseases, but it can also lead to the development of new biomarkers and treatments for lupus and arthritis," said Monica Guma, MD, PhD, an associate professor in the UC San Diego School of Medicine and rheumatologist at UC San Diego Health who was not involved in the study.
Story Source: Materials provided by University of California - San Diego. Original written by Scott LaFee. Note: Content may be edited for style and length.
Journal Reference: Hongxu Xian, Kosuke Watari, Elsa Sanchez-Lopez, Joseph Offenberger, Janset Onyuru, Harini Sampath, Wei Ying, Hal M. Hoffman, Gerald S. Shadel, Michael Karin. Oxidized DNA fragments exit mitochondria via mPTP- and VDAC-dependent channels to activate NLRP3 inflammasome and interferon signaling. Immunity, 2022; DOI: 10.1016/j.immuni.2022.06.007
Disponivel em: https://www.sciencedaily.com/releases/2022/07/220713143955.htm
[C] G Dinkov - http://haidut.me/?p=1937
[D] Restos de DNA mitocondrial oxidado e fragmentado expelidos para o citoplasma e sangue a partir de uma mitocôndria estressada ou disfuncional “disparam reações complexas e destrutivas”. E inflamatórias. Que são as reações, por exemplo, da doença autoimune. E que, portanto, estão causando a doença e não apenas são biomarcadores dela. São agentes dessas e de outras doenças crônico-degenerativas. Portanto, é preciso, concluem os estudiosos, procurar “novos agentes anti-inflamatórios”.
Fragmentos oxidados de DNA eventualmente saem da mitocôndria quando ela entra em estresse e ativam, no citosol, inflamassoma [via ativação de NLRP3] e sinalizam interferon, é o título do trabalho. Interleucina-1beta é produzida. A ativação, pelos restos de RNA mitocondrial de sensores como aquele inflamassoma resulta em produção de interleucina-18, caspase-1, interleucina-1-beta. São mediadores inflamatórios, patogênicos portanto. O que se sabe é que a persistência da sinalização a partir do NLRP3 está presente em muitas doenças crônicas e metabólicas, incluindo obesidade, diabetes tipo 2, aterosclerose, Parkinson, Alzheimer, doenças inflamatórias intestinais. Portanto, a ativação do inflamossoma [via NLRP3] é mecanismo da doença crônico-degenerativa, incluindo doenças autoimunes, e sua ativação por restos da mitocôndria esclarece muita coisa sobre o mecanismo causal daquelas doenças.
***